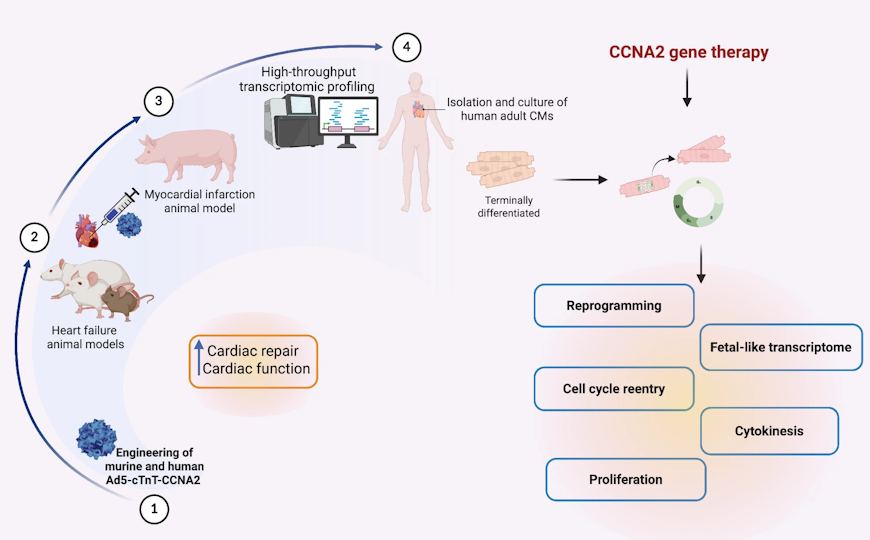
Циклин А2 (CCNA2) — один из ключевых регуляторов клеточного цикла, и его экспрессия выключается в кардиомиоцитах после рождения. Авторы статьи в npj Regenerative Medicine впервые показали на кардиомиоцитах взрослого человека, что восстановление экспрессии CCNA2 с помощью аденовирусного вектора усиливает способность этих клеток к пролиферации. В опытах in vitro они частично дедифференцировались и начинали активнее делиться, причем дочерние кардиомиоциты сохраняли свою функциональность и структуру саркомеров. В перспективе данный механизм позволит восстанавливать миокард после инфаркта — сейчас основным препятствием для этого служит низкий регенеративный потенциал человеческого сердца.
Изображение:
Авторы статьи уже наметили путь для валидации и будущего внедрения генной терапии поврежденного сердца, основанной на экспрессии CCNA2.
Credit:
npj Regenerative Medicine (2025). DOI: 10.1038/s41536-025-00438-7 | CC BY-NC-ND
Циклин A2 (CCNA2) — один из ключевых регуляторов клеточного цикла, который инактивируется в постнатальных кардиомиоцитах. Его влияние на пролиферацию кардиомиоцитов взрослого человека еще не было описано, однако именно их ограниченная пролиферативная способность остается основным препятствием для регенерации поврежденного сердца.
Авторы статьи в npj Regenerative Medicine экспрессировали CCNA2 в кардиомиоцитах, изолированных из сердца взрослого человека. Оказалось, что это индуцирует полноценный цитокинез, сохраняя структуру саркомеров и кальциевую активность во вновь дифференцированных дочерних кардиомиоцитах.
Исследователи сконструировали аденовирусный вектор для селективной экспрессии циклина А2 в кардиомиоцитах человека. Он содержал ген CCNA2 под промотором сердечного тропонина Т (cTnT), специфичным для кардиомиоцитов. Подтвердив экспрессию CCNA2 в трансдуцированных клетках, исследователи перешли к оценке его эффекта in vitro. Они культивировали взрослые кардиомиоциты человека и отслеживали их цитокинез с помощью прижизненной эпифлуоресцентной микроскопии с интервальной съемкой. В клетках также визуализировали структуру саркомеров, экспрессируя в них флуоресцентно-меченный α-актинин.
Активность цитокинеза в кардиомиоцитах, полученных от пациентов возрастом 41 год или 55 лет и трансдуцированных аденовирусом cTnT-CCNA, была значительно выше, чем в контрольных. А вот в кардиомиоцитах 21-летнего пациента такой разницы не обнаружилось. При этом структура саркомеров в дочерних кардиомиоцитах сохранялась после цитокинеза.
Функциональную дифференцировку кардиомиоцитов ученые оценивали, измеряя в них кальциевые токи. Экспрессирующие CCNA2 кардиомиоциты, помещенные в трехмерную агарозную матрицу, активно отвечали на стимуляцию транзиентными Ca²⁺ токами. Таким образом, CCNA2 стимулирует цитокинез кардиомиоцитов взрослого человека, сохраняя целостность саркомера и способность к функциональной активности.
Затем авторы секвенировали РНК сердец человеческого плода и взрослого человека. Анализ дифференциальной экспрессии показал, что в ткани взрослого сердца повышены уровни экспрессии генов, связанных с транспортом кальция и сократительной способностью, а также со сборкой саркомеров (RYR2, ATP2A2, SLC8A1, CALM1, CALM2, NEB, TTN и TNNC). Однако, судя по данным секвенирования РНК трансдуцированных взрослых кардиомиоцитов, CCNA2 реактивирует пролиферацию без полного возврата к фетальным транскриптомным паттернам.
Чтобы подробнее изучить механизм, по которому CCNA2 индуцирует цитокинез во взрослых кардиомиоцитах, исследователи провели секвенирование РНК единичных ядер, полученных из сердца мыши. В анализ включили как контрольных, так и трансгенных животных, конститутивно экспрессирующих CCNA2. Они выявили 16 основных клеточных популяций, включая кардиомиоциты, эндотелиальные клетки, фибробласты, иммунные клетки сердца и нейроны. Популяции кардиомиоцитов храктеризовались экспрессией классических маркеров (Myh7, Actn2 и Tnnc1) как у контрольных, так и у трансгенных мышей.
Среди желудочковых кардиомиоцитов анализ выявил 11 субкластеров, общих для трансгенных и нетрансгенных мышей и отличавшихся только относительной долей в популяции. Пять из них экспрессировали гены, связанные с созреванием кардиомиоцитов. Также авторы обнаружили интенсивно самообновляющуюся, готовую к регенерации субпопуляцию дедифференцированных кардиомиоцитов, готовых к регенерации.
В пролиферативной популяции кардиомиоцитов у CCNA2+ трансгенных мышей экспрессировались ключевые регуляторы клеточного цикла. Анализ обогащения по функциональной принадлежности (GSEA) выявил в кардиомиоцитах таких мышей активацию сигнальных путей, связанных с клеточной пластичностью и пролиферацией. В них активировался сигнальный путь NOTCH, что подчеркивает роль CCNA2 в перепрограммировании сердца. Напротив, митохондриальный метаболизм и окислительное фосфорилирование — характерные признаки зрелых кардиомиоцитов — были ослаблены, то есть CCNA2+-кардиомиоциты возвращались к фетальному пролиферативному фенотипу. Противоположную картину — усиление фиброза и активацию кальциневрина — выявили более ранние работы по транскриптомике сердца при ишемии.
Полученные данные подчеркивают роль CCNA2 в индукции перепрограммирования и дедифференцировки кардиомиоцитов. Это, в свою очередь, активирует их цитокинез, сохраняя функциональность дочерних кардиомиоцитов. Тот факт, что данный механизм подтвердился на клетках сердца взрослых людей, открывает перспективы для разработки регенеративной терапии сердца, поврежденного, например, из-за инфаркта миокарда.
Источник
Bouhamida, E., et al. Cyclin A2 induces cytokinesis in human adult cardiomyocytes and drives reprogramming in mice. // npj Regenerative Medicine (2025). DOI: 10.1038/s41536-025-00438-7