Исследователи из Швеции описали новый механизм, с помощью которого клетки острого миелоидного лейкоза избегают иммунного ответа. Он заключается в аномальной экспрессии маркера SLAMF6, который связывается с той же молекулой на Т-лимфоците, образуя димер, и в результате ингибируется T-клеточный цитолиз. Разработанное исследователями антитело к SLAMF6 предотвращает димеризацию и блокирует иммуносупрессию, вызывая мощный противоопухолевый Т-клеточный ответ как in vitro, так и у гуманизированных мышей.
Credit:
Nat Cancer (2025), DOI: 10.1038/s43018-025-01054-6 | CC BY 4.0
Острый миелоидный лейкоз (ОМЛ) — это агрессивное онкологическое заболевание крови, при котором 5-летняя выживаемость составляет 30%. Современные методы химиотерапии ОМЛ очень токсичны, не сильно улучшают прогноз и не исключают рецидивов заболевания. Иммунотерапия показала выдающиеся результаты при лечении различных видов рака, но лишь незначительно улучшила ситуацию в терапии ОМЛ.
Тяжесть протекания ОМЛ связана с тем, что он инициируется особым типом клеток — лейкозными стволовыми клетками (ЛСК), которые устойчивы к различным видам терапии и способны вызывать рецидивы. Ученые из Лундского университета и университетской больницы в Сконе (Швеция) решили провести скрининг белков на поверхности ЛСК, чтобы выявить специфичные для этих клеток белки, которые могли бы стать мишенями для таргетной терапии.
Исследователи картировали 362 поверхностных белка стволовых клеток в образцах костного мозга трех пациентов с мутацией TP53 при ОМЛ и трех здоровых доноров. При этом обнаружилась повышенная экспрессия поверхностного белка SLAMF6 (signaling lymphocyte activation molecule family member 6) в клетках ЛСК по сравнению с нормальными клетками костного мозга. Это открытие затем подтвердили на 50 пациентах с ОМЛ разных подтипов: высокий уровень SLAMF6 был выявлен у 60% больных.
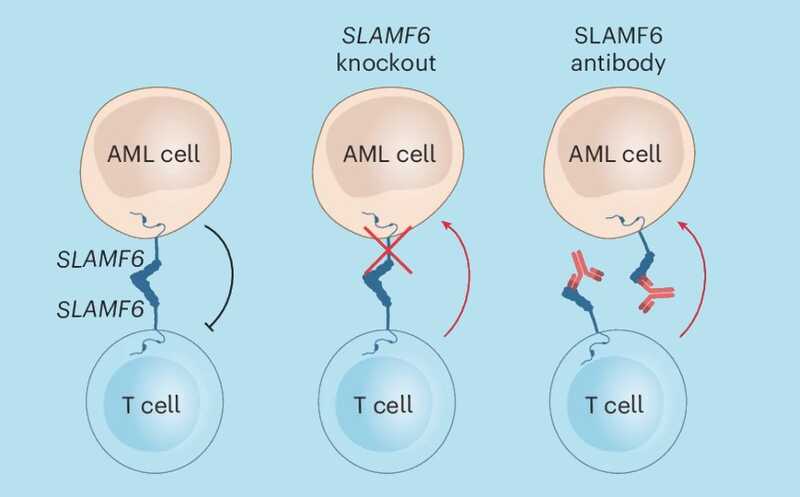
Затем авторы сравнили, насколько успешно уничтожают клетки ОМЛ дикого типа и с нокаутом SLAMF6 первичные Т-клетками при совместном культивировании. Нокаут SLAMF6 в клетках ОМЛ делал их крайне восприимчивыми к Т-клеточному цитолизу, что доказало роль этого белка в защите клетки ОМЛ от распознавания и элиминации иммунной системой.
Исследователи установили, что белок SLAMF6 на ЛСК образует димер, связываясь с тем же белком на поверхности Т-клетки. Это позволило предположить, что блокирование сайта димеризации, например, с помощью антитела усилит противоопухолевый ответ. Для этого методом фагового дисплея было подобрано антитело, которое продемонстрировало высокоспецифичное связывание с SLAMF6 как при иммуноферментном анализе, так и при проточной цитометрии.
Для проверки своей теории in vivo ученые создали гуманизированную животную модель: иммунодефицитным мышам последовательно вводили человеческие клетки ОМЛ и мононуклеарные клетки периферической крови человека. После лечения разработанным антителом у них снизился уровень лейкозной нагрузки в костном мозге на 50%, в селезенке приживаемость ЛСК снизилась на 63%.
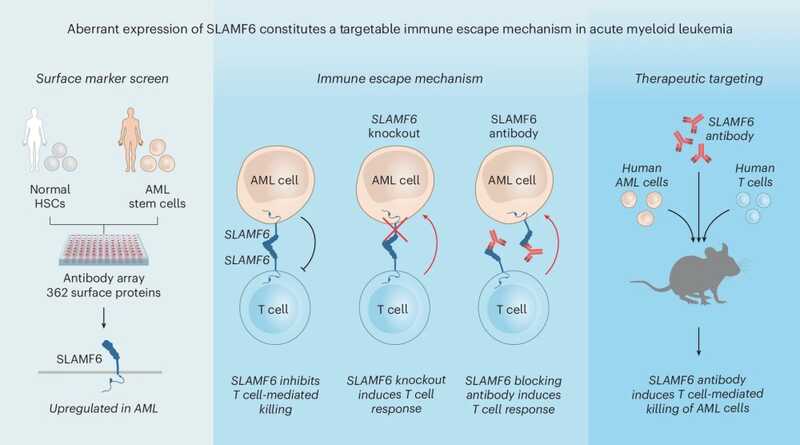
Слева — скрининг поверхностных маркеров клеток ОМЛ. В центре — механизм обхода иммунной системы при ОМЛ. Справа — таргетинг антитела к маркеру SLAMF6 на гуманизированной животной модели. Credit: Nat Cancer (2025), DOI: 10.1038/s43018-025-01054-6 | CC BY 4.0
Таким образом, обнаружен механизм защиты раковых клеток от иммунной системы при ОМЛ и определена связь этого механизма с повышенной экспрессией SLAMF6. Также авторы установили, что антитела, блокирующие образование димера SLAMF6, могут вызвать сильный противоопухолевый Т-клеточный ответ. Дальнейшая разработка и тестирование терапевтической способности таких антител станет важным шагом к разработке терапии ОМЛ.
Среди авторов исследования есть соучредители компании Lead Biologics, которая занимается разработкой противораковых антител.
Источник
Sandén, C., et al. Aberrant expression of SLAMF6 constitutes a targetable immune escape mechanism in acute myeloid leukemia // Nature Cancer (2025), published online 03 October 2025. DOI: 10.1038/s43018-025-01054-6